百济神州是一家全球商业阶段的生物技术公司,专注于开发及商业化创新型分子靶向及肿瘤免疫疗法。于 2010年在北京成立为一家研发公司。过去十年,已发展成一家全方位一体化的全球生物技术公司,拥有强大的商业、生产及研发能力。
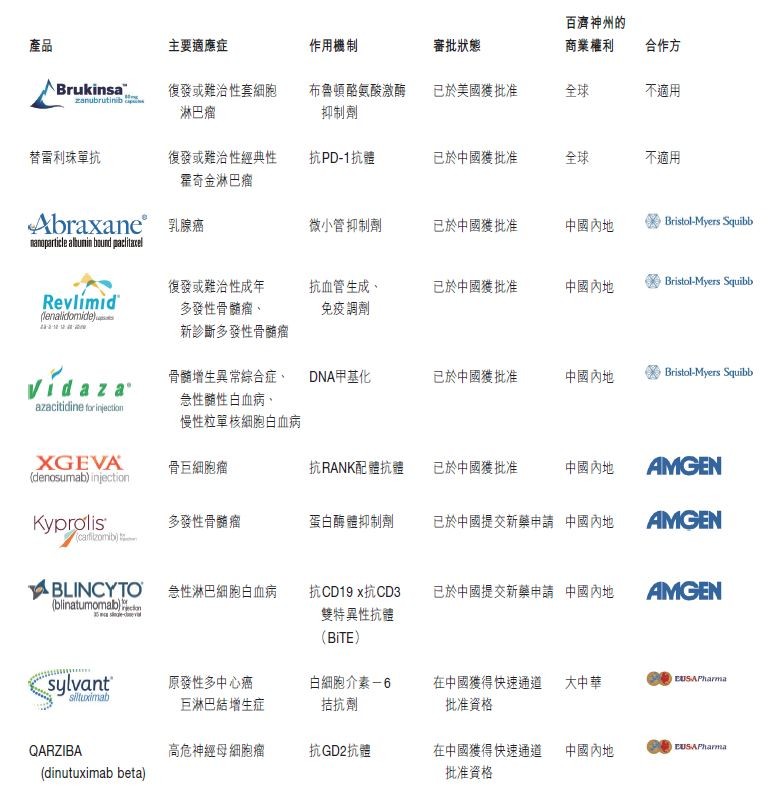
公司已在中国及美国建立了实质性商业能力,目前有两款内部开发药物及三款许可药物正在上市销售。此外,公司预计在未来一至两年内将有五款许可药物进入中国市场。在美国,公司销售BRUKINSA™(通用 名:泽布替尼)用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤患者,在中国,公司销售百泽安®(替 雷利珠单抗注射液)用于治疗至少经过二线系统化疗的经典型霍奇金淋巴瘤患者。于2020年4月,替雷利珠 单抗获得中国国家药品监督管理局(「国家药品监督管理局」)批准第二项适应症,用于治疗接受含铂化疗失 败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性PD-L1高表达的尿路上皮癌患者。公司已在中 国提交三份新适应症上市申请供监管审批,并正计划于2020年在其他适应症中推出。公司的许可组合包括 ABRAXANE®、瑞复美®及维达莎®,根据新基物流有限责任公司(属于百时美施贵宝)的授权,公司自2017 年以来一直在中国销售该等药物。公司计划在中国推出更多来自公司合作方的授权产品,包括来自安进公司(「安进」)的安加维®(XGEVA®)(地舒单抗注射液)、KYPROLIS®(卡非佐米)及BLINCYTO®(倍林妥莫双抗) 及来自EUSA Pharma(「EUSA」)的SYLVANT®(司妥昔单抗)及QARZIBA®▼(dinutuximab beta)。
公司已建立了强大的临床开发能力,包括一支1,100多人的全球临床开发团队正在管理逾60项正在进行或已计划的已入组超过7,500名患者及健康受试者的临床试验。公司正在对BRUKINSA及替雷利珠单抗进行后期临床试验,包括26项针对15类离散型癌症适应症的注册或在注册临床试验。公司的内部研发能力已取得另一款后期资产pamiparib,而其他五款内部开发候选药物现正处于早期临床开发阶段。此外,公司已能够利用我们的能力及中国作为临床科学中心的重要地位,扩大公司的临床及临床前投资组合及许可候选药物。公司亦正与优质合约生产机构合作,在中国及全球范围内生产公司的内部开发商业及临床产品,并已在中国建立先 进的小分子及生物生产设施,以支持公司内部开发产品投放市场及潜在的未来需求。
公司策略
公司的使命乃成为发现、开发及商业化创新型癌症治疗药物的全球领导者。公司的策略要点如下:
利用BRUKINSA(泽布替尼)及替雷利珠单抗实现两大商业机会。泽布替尼为一种全资拥有、潜在同类最佳的布鲁顿酪氨酸激酶的小分子抑制剂,用于B细胞恶性肿瘤。基于泽布替尼实现全部布鲁顿酪氨酸激酶占有率及减少脱靶结合的能力,公司认为其较其他获批准的布鲁顿酪氨酸激酶疗法可能更具疗效及安全优势。布鲁顿酪氨酸激酶抑制剂在全球拥有巨大的商业机会,根据公开报告,2019年其全球收入总额约为58亿美元。公司认为,迄今为止公司对2,500多名患者的临床经验及公司广泛的临床开发计划使公司有优势把握该商业机会。于2019年11月,公司获美国食品药品监督管理局对BRUKINSA的加速批准,用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤患者。公司已在美国建立商业团队,并2019年底推出BRUKINSA。此外,公司已于中国就泽布替尼用于治疗复发或难治性套细胞淋巴瘤患者及复发或难治性慢性淋巴细胞白血病患者或小淋巴细胞淋巴癌患者提交两项新药上市申请。此两项申请正在进行优先审评。公司正在就泽布替尼开展广泛的临床研究,预期将公布作为单药及联合用药的近期数据。
公司最近获批准的药物是替雷利珠单抗,一种全资拥有的针对免疫检查点受体抗程序性死亡受体1(「 P D - 1 」)的 抗 体 , 旨 在 尽 量 减 少 被 认 为 在 激 活 巨 噬 细 胞 吞 噬 作 用 中 起 关 键 作 用 的 Fcγ受体结合,从而尽量减少其对效应T细胞的负面影响。于2019年12月,公司获国家药品监督管理局批准上市销售替雷利珠单抗,用于治疗至少经过二线系统化疗的经典型霍奇金淋巴瘤患者,且公司已于2020年3月在中国推出替雷利珠单抗。此外,于2020年4月,公司就替雷利珠单抗获得国家药品监督管理局批准用于治疗接受含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性PD-L1高表达的尿路上皮癌患者。此乃替雷利珠单抗获批的第二项适应症,也是首项获批的实体瘤适应症。公司认为,中国的新型癌症疗法具有巨大且不断增长的机遇,PD-1/PD-L1抗体疗法的市场机遇可能尤其具有吸引力,原因为此类药物于中国最常见的四种肿瘤(肺癌、胃癌、肝癌及食管癌)中均表现出抗肿瘤活性。根据公开报告,与其他地区如美国及欧洲相比,中国年度癌症发病率中对PD-1应答的肿瘤比例更高。中国十大PD-1 应答肿瘤的年度发病率预计为300万,年度癌症总发病率为430万。公司认为公司于中国的强大影响力及丰富经验、全球临床开发能力、发展计划的广度(迄今为止已入组5,000多名患者,包括15项注册性或潜在注册性临床试验)及高质量生产使公司处于独特地位,能够抓住这一机遇。
利用公司的关键战略临床及商业能力。公司认为,中国监管环境的近期变化为公司的行业带来了前所未有的机遇。过往,中国的监管环境被认为极具挑战性,临床开发延迟及监管批准花费的时间相较美国及欧盟更长。为解决该等问题,国家药品监督管理局已发布一系列改革政策及意见,其中包括,扩大临床患者的准入及透过消除延迟及为于中国的药物开发、生产及商业化创建符合国际质量标准的环境,为加快药物开发及批准创造机会。该等监管改革将令中国的临床试验于全球药物开发项目中发挥重要作用,且中国产生的数据已用于辅助中国境外的批准。然而,从这些改革中获益仍存在挑战,包括合约研究机构能力有限、人才有限及临床数据及试验管理方面的挑战。公司的策略是在中国积极建立公司的临床开发及商业能力,以利用该等变革及减轻以临床科学中心身份进入中国的挑战。公司的全球肿瘤开发团队由1,100多名雇员组成,其中约60%在中国。公司致力于开展符合最高国际协调会议标准的研究。公司已启动12项全球(包括中国在内)关键性研究及26项关键或潜在注册性研究。公司有超过60项正在进行或计划中的临床试验,且公司的临床试验已入组7,500多名患者及健康受试者。从商业角度,公司在中国的战略是透过国家医保报销让公司的产品能够更广泛地惠及需要创新药物的患者。该策略需要一个庞大的商业组织。公司的商业能力已由2017年收购新基(现属于百时美施贵宝)位于中国的商业业务时的仅150多人增加至2019年底的900多人。公司认为,公司在中国推出公司的现有及未来内部开发管线及许可药物以及利用已改善的国家医保报销的机会方面处于有利地位。
透过利用公司的临床及商业能力扩大公司的组合。由于许多领先的制药公司及生物技术公司会评估在中国的机遇,公司认为与公司合作能使该等公司高效地按国际质量标准获得深层次的当地临床开发、商业及生产能力。例如,透过公司与安进的合作,公司已利用公司独有的(包括中国在内)开发及商业能力扩大公司的组合。此外,公司自2017年以来已进行逾10宗交易,于该等交易中,公司已将创新型临床前、临床及╱或商业阶段药物及候选药物列入公司的组合内。公司的策略是继续积极评估获得许可的机遇,以增加公司的药物及候选药物管线。
开创全球增长新模式。公司认为,透过允许药物的研发投资于更庞大的患者群体中发挥杠杆作用,在中国大量的可接受治疗的患者人群规模及创新型药物报销范围扩大可为公司行业的增长提供全新的商业模式,与传统优先市场模式相比,这可使更多药物以更实惠的价格进入全球市场。此全球准入及定价模式将使公司能够利用公司在中国及全球范围内强大的临床及商业能力,亦为取得开发候选药物组合的投资回报提供机会。公司透过研究机遇、启动风险及成本以及公司的能力评估全球市场。其后,公司设计了有针对性的市场进入策略,并计划基于投资及回报分析分阶段进入该等全球市场。为把握此等机遇,公司计划在全球范围内寻求公司组合内的化合物的批准。
业务
公司的主要产品如下
BRUKINSA
BRUKINSA是一种设计旨在最大化布鲁顿酪氨酸激酶占有率、最小化脱靶效应的第二代小分子抑制剂。于 2019年11月14日,BRUKINSA获得美国食品药品监督管理局加速批准用于治疗既往接受过至少一项疗法的 成年套细胞淋巴瘤患者。BRUKINSA是首款由百济神州自主研发获批上市的产品。目前,公司已拥有一支 100多个人的商业团队在美国营销推广BRUKINSA。在中国,公司已就治疗复发或难治性套细胞淋巴瘤患者 以及复发或难治性慢性淋巴细胞白血病╱小淋巴细胞性淋巴瘤患者提交新药申请,及该等申请正待优先审评。
替雷利珠单抗
替雷利珠单抗是一种针对免疫检查点受体PD-1的人源化IgG4单克隆抗体,设计目的是最大限度地减少与Fcγ受体结合进而启动巨噬细胞的吞噬作用,以尽量减少其对T-效应细胞的负面影响。替雷利珠单抗目前正于全球和中国就实体瘤及血液肿瘤适应症开展的全面的关键性临床项目中进行评估,公司已于2018年于中国提交用于治疗复发或难治性经典型霍奇金淋巴瘤的新药申请供审批,该申请获得优先审评资格并于2019年12月26日获批。公司正在中国市场销售替雷利珠单抗。公司亦已于2019年5月在中国提交治疗尿路上皮癌的新适应症上市申请,该申请获得优先审评资格并于2020年4月获批,及公司预期于2020年根据2020年1月公布的3期研究中的正面中期分析提交一份一线鳞状非小细胞肺癌的新适应症上市申请。此外,公司计划于2020年与监管机构讨论我们针对二线或三线肝细胞癌进行的2期研究,及公司预期于2020年从替雷利珠单抗的几项研究中得出结果。公司在新基被百时美施贵宝收购前与新基终止合作协议,之后公司拥有替雷利珠单抗的全部商业权利。
ABRAXANE
ABRAXANE注射用紫杉 醇(纳米白蛋白颗粒结合型)乃一种使用百时美施贵宝专有纳米白蛋白颗粒结合 型(nab®)技术平台开发的无溶剂化疗产品。该蛋白的化疗药物将紫杉醇与白蛋白结合。于全球范围内, ABRAXANE获批准用于乳腺癌、非小细胞肺癌、胰腺癌及胃癌,不同地域存在获批适应症差异。于中国, ABRAXANE获批准用于治疗转移性疾病联合化疗失败后或于辅助化疗六个月内复发的转移性乳腺癌。除非临床禁忌,先前的疗法则应包括蒽环类抗生素药物。
于中国销售的紫杉烷包括两种品牌的溶剂型紫杉醇(TAXOL®及ANZATAX)制剂、一种品牌的多西他赛(TAXOTERE®)制剂、一种紫杉醇脂质体(力扑素®)、一种白蛋白结合型紫杉醇(ABRAXANE)及溶剂型紫杉烷 的仿制药以及ABRAXANE,包括来自石药集团、恒瑞及齐鲁制药的白蛋白结合型紫杉醇产品。力扑素目前乃市场领导者,拥有约三分之一的市场份额。
瑞复美
瑞复美(来那度胺)乃一种口服免疫调节药物,于2013年于中国获批与地塞米松联合用药用于治疗先前曾接受至少一次治疗的多发性骨髓瘤成人患者。于2018年2月,瑞复美获得国家药品监督管理局批准新的适应症,与地塞米松联合用药用于治疗不符合移植资格的之前未曾接受多发性骨髓瘤治疗的多发性骨髓瘤成人患者。
维达莎
维达莎(注射用阿扎胞苷)乃一种已获证明可逆转DNA甲基化作用并促进后续基因重新表达的嘧啶核苷类似物。维达莎于2017年4月于中国获批用于治疗中危-2及高危骨髓增生异常综合症、慢性粒单核细胞白血病及伴有20%至30%骨髓原始细胞的急性髓性白血病。于2018年1月,维达莎开始在中国商业化。
安加维
安 加 维( 地 舒 单 抗 )是 一 种 抗 体 R A NK 配 体(「 R A N KL」)抑制剂,经全球批准用于预防多发性骨髓瘤患者的骨相关事件、预防实体瘤骨转移患者的骨相关事件及治疗骨巨细胞瘤的成人及骨骼发育成熟的青少年患者。安加维于全球70个以上的国家获得批准。于中国,其已于2019年获批准用于治疗骨巨细胞瘤患者,目前正在中国针对骨转移癌症患者的骨相关事件的预防进行开发。
KYPROLIS
KYPROLIS(卡非佐米),一种蛋白酶体抑制,已获得超过 60 个国家的批准用于治疗复发及╱或难治性多发性骨髓瘤。其已作为多发性骨髓瘤患者的治疗方案在中国提交申请,且国家药品监督管理局已受理该新药申请。
BLINCYTO
BLINCYTO(倍林妥莫双抗),一种双特异性CD-19定向CD3 T细胞衔接抗体,乃获批的首个兼唯一一个双特异性T细胞衔接免疫疗法。其已获60个国家的批准用于治疗急性淋巴细胞白血病患者。其已作为复发╱难治性急性淋巴细胞白血病成人患者的治疗方案在中国提交申请,且国家药品监督管理局已受理该新药申请并将其纳入优先评审。
临床开发计划
我们于2019年11月获得美国食品药品监督管理局加速批准将泽布替尼用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤患者。此外,美国食品药品监督管理局已于2018年7月授予泽布替尼用于治疗华氏巨球蛋白血症患者的快速通道认定以及于2019年1月授予用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤患者的突破性疗法认定。我们计划在2020年与美国食品药品监督管理局及欧洲药品管理局讨论我们在华氏巨球蛋白血症方面的ASPEN研究成果。在中国,我们已宣布,我们分别于2018年8月及2018年10月提出的复发或难治性套细胞淋巴瘤及复发或难治性慢性淋巴细胞白血病╱小淋巴细胞淋巴瘤临床试验申请已获接纳,我们预期2020年上半年将就两种适应症获得批准。我们亦预期于2020年就泽布替尼用于治疗复发或难治性华氏巨球蛋白血症在中国提交一份新适应症上市申请。